|
Wenn
Sie sich für Informationen aus der Frühzeit der
DGRA interessieren,
HIER klicken. |
Informationen vom
Beginn 2005 bis 2014
| Seit 2009 läuft der (zulassungsbeschränkte) Studiengang "Arzneimittelforschung"
(Drug Research), der mit dem attraktiven Titel M. Sc. (Master of Science)
abgeschlossen wird. Im Rahmen diese Studienganges kann man DRA als "Nebenfach", (Wahlpflichtbereich
B), mit 180 h = 6 LP bewertet, besuchen. Der Kurs (WPMB1) beginnt
immer im
Januar und endet im Dezember. Auf "Semesterferien" nehmen wir keine
Rücksicht, daher ist der (dreisemestrige) Kurs in einem Jahr (incl.
Prüfung) zu schaffen. Ein Einstieg ist jederzeit möglich. Doktoranden
der Pharmazie in Bonn können - so Plätze vorhanden -
(Teilnehmerbescheinigung, a.W. mit Prüfung und Note) teilnehmen. Interessenten für den Kurs bitte
per mail bei schweim (at) web.de melden. |
(leicht) gekürzte Fassung des Modulangebots in DRA
--------------------------------------------------------------------------------------------------
Ein Grillfest
für die Doktorand(inn)en gab es 2013 leider
nicht.
Dissertationen 2013
|
Mit großer Freude kann ich mitteilen, dass
die siebzehnte DRA-Dissertation in Bonn
"Strategien zur
Erhöhung der Anwendungssicherheit von Arzneimitteln in stationären
Pflegeeinrichtungen - Möglichkeiten und Grenzen*"
durch
Herrn Apotheker Thomas Uhrhan, M.Sc.
am
25.07.13 mit der Verteidigung abgeschlossen wurde.
* Hauptbetreuung durch
Frau Prof. Dr.
M.
Schaefer, Charité Universitätsmedizin Berlin
|

Herzlichen
Glückwunsch! |
|
Mit großer Freude kann ich mitteilen, dass
die sechzehnte DRA-Dissertation in Bonn
"Off-Label-Use von Arzneimitteln in der Palliativmedizin"
durch
Frau Apothekerin Katrin Hafner
am
15.02.13 mit der Verteidigung abgeschlossen wurde.
|

Herzlichen
Glückwunsch! |
|
Mit großer Freude kann ich mitteilen, dass
die fünfzehnte DRA-Dissertation in Bonn
"eCTD
- Neue Wege der elektronischen Einreichung - Vernetzung elektronischer
regulatorischer Prozesse -
"
durch Herrn Apotheker
Jörg
Schnitzler
am 21.01.13 mit der Verteidigung abgeschlossen wurde.
|

Herzlichen
Glückwunsch! |
Dissertationen 2012
|
Mit großer Freude kann ich mitteilen, dass
die vierzehnte DRA-Dissertation in Bonn
"Notwendigkeit klinischer Prüfungen bei technischen Änderungen an
der
Applikationseinheit von Inhalationsprodukten"
durch Frau Dipl.-Ing. Kris Pelzer,
M.D.R.A., am 03.12.12 mit der Verteidigung abgeschlossen wurde.
|

Herzlichen Glückwunsch! |
|
Mit großer Freude kann ich mitteilen, dass
die dreizehnte DRA-Dissertation in Bonn
"Pflanzliche Gesundheitsprodukte auf dem Arzneimittel- und
Lebensmittelsektor - Regulation von Arzneimitteln und Lebensmitteln
im Grenzgebiet unter
Berücksichtigung der begrifflichen Abgrenzung
Arzneimittel Lebensmittel"
durch Frau Apothekerin
Christiane Quintus am 30.11.12 mit der Verteidigung abgeschlossen wurde.
|

Herzlichen Glückwunsch! |
|
Mit großer Freude kann ich mitteilen, dass
die zwölfte DRA-Dissertation in Bonn
"Quality
Assurance and Safety issue of Medicine Products
marketed in developing Countries"
durch Herrn Apotheker
N´djamawe Bah-Traore, M.D.R.A., am 07.11.12 mit der Verteidigung abgeschlossen wurde.
|

Herzlichen Glückwunsch! |
................................................................
|
|
|
Für frühere Dissertationen:
Bitte weiter herunterscrollen ! |
|
Wir haben auch 2012 unseren
Doktorandentag durchgeführt:
 |
 Ein Blick in das Auditorium am Doktorandentag 2012 in dem schönen
Seminarraum in der Brühler Str. 7 in Bonn. Ich war mit der Qualität der Präsentationen außerordentlich
zufrieden. In sehr naher Zukunft werden sechs Dissertationen
abgeschlossen werden.
Die Vorträge können (auf
den Namen klicken) abgerufen werden:
Jepards -
Weidner -
Pelzer -
Uhrhan -
Hafner - Wolf
Lazowska -
Müller
-
Krüger
-
Bauer -
Krollmann
|
Ein
Doktorandentreffen 2012 gab es
leider nicht.
Training für die Chinesische
Zulassungsbehörde (SFDA) 2011

Auch
2011 bat die SFDA um ein Training zum europäischen Zulassungssystem. So waren unter der Delegationsleitung von
Mrs.
Duan Huiping,
Deputy Director-General of Dept. of
Personnel, State Food and Drug Administration (SFDA)
vom
11.11. bis einschließlich 18.11.2011 zwanzig Personen
in Bonn zu Gast. Das
Training
– organisiert durch Prof. Dr. Harald G. Schweim - wurde unter
Mitwirkung von Kolleginnen und Kollegen aus dem
Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), des
Paul-Ehrlich- Instituts (PEI), Vertretern der
Industrie, des Lehrstuhls, der Landesbehörde, der Wissenschaft und
freiberuflichen Consultants durchgeführt. Bedauerlicherweise hatte der neue Leiter des BfArM, Prof. Dr. W. Schwerdtfeger, den sonst
üblichen "BfArM-Tag" (BfArM-Besuch) wegen der dort statt findenden
Umorganisation abgesagt, wodurch er durch Vorträge von BfArM-Kolleg(inn)en im
Rahmen der Schulung ersetzt werden musste. In dem Bonner Training mit
Schwerpunkt auf die neuen Verfahren in der Biotechnologie und Advanced
Therapies wurden sämtliche
Aspekte der Arzneimittelbewertung und –zulassung nach den Regeln der
Europäischen Gemeinschaft und auch das Inspektionswesen behandelt. In
fast 70 Vortragsstunden wurde von ausgewiesenen Experten ihres Faches
„Spezialwissen“ vermittelt und ausgiebig diskutiert. Besonders die regen und
ausführlichen Diskussionen, in denen auch die chinesischen Kolleginnen und
Kollegen ihr großes Fachwissen darstellten,
beeindruckten die Vortragenden immer wieder und zeigten das große Interesse
der chinesischen Gäste an der europäischen Zulassung. Besonders
bemerkenswert ist, dass China inzwischen das e-CTD in vielen Bereichen
akzeptiert und auch sonst Etliches aus dem europäischen System übernimmt
bzw. übernommen hat. Auch hier sind wir stolz, dazu beigetragen zu haben.
Das derzeitige Programm ist damit abgeschlossen, insgesamt wurden rd. 100
Personen aus der Zentrale und den Provinzen geschult. Nachgedacht wird über
eine Fortsetzung in anderen Schwerpunktfeldern. Die Delegation wird vor der
Rückreise noch das Paul-Ehrlich-Institut in Langen besuchen und dort von
Prof. Dr. Klaus
Cichutek
und seinen Mitarbeitern empfangen werden.

 |
 Oben: Prof. Dr. R. Bass

Oben: Dr. K Brixius
Links: Schweim, Bauer und der ausgezeichnete Übersetzer |
 PD Dr. H. Enzmann |
|
 Dr. U. Muazzam |
 Dr. F. Hackenberger |
 Prof. Dr. J. Röhmel |
 Dr. B. Lehmann |
 Dr. G. Disselhoff |
 Prof. Dr. H. Schweim |
 Dr. G. Hennings |
 Dr. C. Mayer-Nicolai |
| leider keine Bilder von Frau Müller, Dr. Noster, Dr. Menges, Dr.
Röther, Herrn Schnitzler, Dr. Zapf |
 Prof. Dr. C. Schröder |
Bilder vom Doktorandentreffen am 13.08.2011:
 |
Zum ersten Mal "mutierte " unser Fest - mit Ausnahme dieses
Photos - zur reinen "Indoor"-Veranstaltung, der Dauerregen wollte
einfach nicht aufhören. |
Das unvermeidliche Gruppenbild. Leider waren etliche Doktorand(inn)en und
"Ehemaligen" verhindert.
Dissertationen 2011
|
Mit großer Freude kann ich mitteilen, dass
die elfte DRA-Dissertation in Bonn
"Die
wechsel-seitigen Effekte des Arzneimittel- und Sozialrechts beim Off-Label-, Unlicensed- und Compassionate-Use von Arzneimitteln"
durch Frau
Fachapothekerin Petra Nies am 27.06.11 mit der Verteidigung abgeschlossen wurde.
|

Herzlichen Glückwunsch!
|
|
Mit großer Freude kann ich mitteilen, dass
die zehnte DRA-Dissertation in Bonn
"Comparison of a global submission of new biological entity and a new
chemical entity – strategic decisions and criteria for implementation"
durch Frau
Apothekerin Andrea Herrmann M.D.R.A. am 20.05.11 mit der Verteidigung abgeschlossen wurde.
|

Herzlichen Glückwunsch!
|
|
Mit großer Freude kann ich mitteilen, dass
die neunte DRA-Dissertation in Bonn
„Lifecycle-Management
von Arzneimitteln
in Pharmaunternehmen einer mittleren Größenordnung unter
Berücksichtigung der
regulatorischen Rahmenbedingungen*“
durch Herrn Apotheker
Matthias Wilken, M.D.R.A. am 08.04.11 mit der Verteidigung abgeschlossen wurde.
* Hauptbetreuung durch
Frau Prof. Dr. B.
Sickmüller, Universität Marburg und BPI, Berlin
|

Herzlichen Glückwunsch! |
|
Mit großer Freude kann ich mitteilen, dass
die achte DRA-Dissertation in Bonn
"Analyse der
ambulanten ärztlichen Versorgung im Rahmen von
Pharmako-therapieberatungen und Wirtschaftlichkeitsprüfungen nach dem
Sozialgesetzbuch V unter Verwendung definierter Tagesdosen (DDD)*"
durch Frau Apothekerin
Dorothee Brakmann am 28.02.11 mit der Verteidigung abgeschlossen wurde.
* Hauptbetreuung durch
Frau Prof. Dr. M.
Schaefer, Charité Berlin |

Herzlichen Glückwunsch!
|
Training für die Chinesische
Zulassungsbehörde (SFDA) 2010


Wie schon
2009 bat die SFDA auch 2010 um ein Training zum europäischen
Zulassungssystem, diesmal insbesondere für Mitarbeiter der SFDA in den
chinesischen Provinzen. So waren unter der Delegationsleitung von
Mr. Yin Hongzhang, stellv. Direktor des „Center for Drug
Evaluation“ der SFDA, vom
26.11. bis einschließlich 03.12.2010 zwanzig Personen aus
Gansu, Guangdong, Hubei,
Jilin, Shanghai, Sichuan und Beijing in Bonn zu Gast. Das
Training
– organisiert durch Prof. Dr. Harald G. Schweim - wurde unter
entscheidender Mitwirkung von Kolleginnen und Kollegen aus dem
Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) , Vertretern der
Industrie und der Landesbehörde durchgeführt. In diesem Training mit
Schwerpunkt auf die neuen Verfahren in der Biotechnologie wurden sämtliche
Aspekte der Arzneimittelbewertung und –zulassung nach den Regeln der
Europäischen Gemeinschaft und erstmals auch das Inspektionswesen
angesprochen. In fast 70 Vortragsstunden wurde von ausgewiesenen Experten
ihres Faches „Spezialwissen“ vermittelt und ausgiebig diskutiert. Besonders
die regen und ausführlichen Diskussionen, in denen die chinesischen
Kolleginnen und Kollegen auch ihr großes Fachwissen darstellten,
beeindruckten die Vortragenden immer wieder und zeigten das große Interesse
der chinesischen Gäste an der europäischen Zulassung. Ergänzt wurde das
Vortragsprogramm durch einen Besuch im BfArM mit Fachvorträgen.
Im
Abschlussgespräch äußerten sich die Teilnehmer sehr lobend über die
Kompetenz der Vortragenden und die ausgezeichneten Vorträge. Insbesondere
die Mischung zwischen behördlichen, akademischen und industriellen
Vertretern wurde als sehr geeignet für derartiges Training hervorgehoben.
Aus der
Sicht des Lehrstuhls zeigt dieses Schulungsprogramm auch, wie gut Behörden,
Industrie uns Akademia zusammenarbeiten können und Kooperationsverträge mit
Leben erfüllen. Es wird in den nächsten Jahren weitere entsprechende
Schulungsveranstaltungen geben.

Bilder vom Doktorandentreffen am 14.08.2010:
Das unvermeidliche Gruppenbild. Leider waren 7 Doktorand(inn)en und
unsere 2 frisch Promovierten verhindert.

Dissertationen 2010
|
Mit großer Freude kann ich mitteilen, dass
die siebente DRA-Dissertation in Bonn
"Möglichkeiten und
Grenzen einer patientenfreundlicheren Gestaltung von Packungsbeilagen im
Hinblick auf Inhalte, formale Gestaltung und Textumfang*"
durch Frau Apothekerin
Claudia Hertzsch am 27.07.10 mit der Verteidigung abgeschlossen wurde.
* Mitbetreuung durch
Dr. Jörg Fuchs,
PAINT consult, Jena,
und Gastwissenschaftler
am Lehrstuhl, auf dem Bild ganz rechts. |

Herzlichen Glückwunsch! |
|
Mit großer Freude kann ich mitteilen, dass
die sechste DRA-Dissertation in Bonn
"Die
Arzneimittelsicherheit bei Humanarzneimitteln mit besonderer Betrachtung des
Einflusses von Krisenfällen auf die Regelsetzung"
durch Herrn Dipl. Biol. Herbert Büttner am 11.05.10 mit der
Verteidigung abgeschlossen wurde.
|

Herzlichen Glückwunsch! |
|
Mit großer Freude kann ich mitteilen, dass
die fünfte DRA-Dissertation in Bonn
"Vergleich
von Medizinproduktegesetz und Arzneimittelgesetz unter besonderer
Berücksichtigung des Inverkehrbringens und der klinischen Prüfung
"
durch Frau Apothekerin
Andrea
Brigitte Gall am 16.04.10 mit der Verteidigung
abgeschlossen wurde. |

Herzlichen Glückwunsch! |
Zum Starten auf das Bild klicken!!
Dissertationen 2009
|
Mit großer Freude kann ich mitteilen, dass
die vierte DRA-Dissertation in Bonn
"Analyse der Arzneimittel-gesetze in Polen, Lettland und Malta unter
besonderer Berücksichtigung des Parallelimports"
durch Frau Apothekerin Ester Timm-Kilian,
M.D.R.A. am 15.01.10 mit der Verteidigung abgeschlossen wurde. |

Herzlichen Glückwunsch! |
|
Mit großer Freude kann ich mitteilen, dass
die dritte DRA-Dissertation in Bonn
"The
Impact of Off-Label, Compassionate and Unlicensed Use on Health Care Laws in
preselected Countries"
durch Frau Apothekerin Vanessa Plate
am 23.10.09 mit der Verteidigung abgeschlossen wurde.
Frau Plate hat in der auf die Verteidigung folgenden Woche
auch noch ihren "Fachapotheker für Arzneimittelinformation", bei dem ich
sie auch betreuen durfte, abgeschlossen. |
Herzlichen Glückwunsch! |
|
Mit großer Freude kann ich mitteilen, dass
die zweite DRA-Dissertation in Bonn
„Die
Informationspolitik der Pharmaverbände in Deutschland und deren
Auswirkung auf die regulatorische Gesetzgebung“
durch Frau Apothekerin Dipl. Pharm. Verena Isabella
Stumpf, M.D.R.A. am 24.07.09 mit der
Verteidigung abgeschlossen wurde.
|

Herzlichen Glückwunsch! |
|
Mit großer Freude kann ich mitteilen, dass
die erste DRA-Dissertation in Bonn
"Maßnahmen zur Risikodetektierung und
Risikominimierung in Apotheken"
durch Herrn Apotheker Daniel Lewinski am
17.06.09 mit der Verteidigung abgeschlossen wurde.
Die Arbeit wurde von der Apothekerkammer
Berlin sachlich und finanziell unterstützt.
Preisgekrönte Projekte
waren :
|
Einen ersten und drei zweite Preise hat die
Förderinitiative Pharmazeutische Betreuung bei
ihrer Mitgliederversammlung in Berlin vergeben
Die ausgezeichneten Doktor-, Diplom- oder
Projektarbeiten beschäftigen sich mit allgemeinen
Maßnahmen zur Erhöhung der Arzneimittelsicherheit
und der Pharmazeutischen Betreuung spezieller
Patientengruppen.
|
2. Preis:
Dr.
Daniel
Lewinski,
derzeit
Europäische
Zulassungsbehörde
EMEA:
»Maßnahmen
zur
Risikodetektierung
und
Risikominimierung
in
Apotheken«
(Doktorarbeit
bei der
Apothekerkammer
Berlin und
der
Universität
Bonn)
|
|
|
|
|
|
Seiten-ID:
Beitrag erschien in Ausgabe 47/2009
|

Herzlichen Glückwunsch! |
2.ter DRA-Doktorand(inn)entag 2009
Am Samstag, den 25.04.09 veranstaltete der Lehrstuhl "Drug
Regulatory Affairs" von 9:00 bis 18:20 im Hörsaal des Pharmazeutischen
Instituts der Universität Bonn seinen Doktorand(inn)entag. Die
Doktorand(inn)en haben in Vorträgen aus bzw. über ihre Arbeiten berichtet.
Es wurde sehr gut präsentiert und lebhaft, auch unter Beteiligung der Gäste,
diskutiert. Alle Teilnehmer waren sich einig, dass es eine erfolgreiche und
informative Veranstaltung für alle war. Das Programm:
Training für die
Chinesische Zulassungsbehörde (SFDA) 2009:
 |
siehe auch PZ, 51/52, S. 16 vom 17.12.09 |
| Siehe auch DAZ 2, 69 (2010) vom 14.01.10 |
 |
Bilder vom Doktorandentreffen am 15.08.2009:
Das unvermeidliche Gruppenbild. Leider waren 5 Doktorand(inn)en und
unsere 2 frisch Promovierten verhindert.
-----------------------------------------------------------------------------------------------------------------------
Das Großereignis 2009, wir waren Gastgeber der "Phytopharm"
(auf das Bild klicken!)

|
Phytopharm 2009“ - Auf dem Weg zur weltumspannenden Phytotherapie
Die „Phytopharm“ ist eine Gründung (1991) russischer Wissenschaftler,
ausgehend vom Institut für Pharmazie in St. Petersburg sowie der Russischen
Akademie der Medizinischen Wissenschaften, um nach Öffnung der Systeme den
Austausch mit Wissenschaftlern, auch der Industrieländer, zu beginnen und zu
intensivieren. Die ersten Kongresse fanden in St. Petersburg statt, dann in
Osteuropa und seit 2000 auch international. Bei den jährlich stattfindenden
Kongressen kommt man jedes zweite Jahr zurück nach St. Petersburg. Dieses
Jahr war Bonn an der Reihe. Unter der erfahrenen Führung von Prof. Dr.
Harald Schweim, Lehrstuhl für Drug Regulatory Affairs der Universität Bonn,
wurde vom 29. bis 31. Juli 2009 ein bemerkenswerter Kongress an der
Universität Bonn durchgeführt. Bemerkenswert vor allem wegen der großen
Teilnehmerzahl von weit über 120 eingeschriebenen Teilnehmern. Und
bemerkenswert auch wegen der großen Anzahl ausländischer Teilnehmer
insbesondere aus Weltgegenden, von denen man sonst nur selten
Wissenschaftler begrüßen kann. Zu nennen wären hier Länder wie Ukraine,
Iran, aber auch Russland, Indien, Brasilien und China. Von der
ursprünglichen Idee des vorbehaltlosen „Voneinander Lernens“ ist man
mittlerweile etwas abgekommen. Die Länder Osteuropas und auch Arabien sowie
auch andere Weltgegenden passen sich mehr und mehr den regulatorischen
Anforderungen der Europäischen Union und der USA an. Dies ist im Prozess der
Globalisierung auch nicht weiter verwunderlich, eröffnet es doch zunehmend
die Möglichkeiten der Gespräche auf „Augenhöhe“. Der große Vorteil ist: es
können Traditionen und Ressourcen weltweit nunmehr besser zusammengeführt
werden. Dies war auch das Ziel in Bonn und hat zu einer erfolgreichen Tagung
geführt. Wie eng und freundschaftlich Wissenschaftler aus ehemals
unterschiedlichen gesellschaftlichen Systemen heute miteinander umgehen
können, wurde bereits auf der Eröffnungsveranstaltung deutlich. Prof. Valery
Makarov vom Institut für Pharmazie der Universität St. Petersburg, Prof.
Konstantin Eller, von der russischen Akademie der Medizinischen
Wissenschaften, die Bonner Professoren Schweim und Steffens sowie Prof.
Wolfgang Blaschek, von der Gesellschaft für Arzneipflanzenforschung (GA)
waren sich einig, dass mit der Plattform Phytopharm etwas Besonderes
geschaffen wurde, das es zu erhalten gilt. Jeder, der schon
wissenschaftliche Tagungen auf internationaler Ebene, z.B. bei der
Weltgesundheitsorganisation, unter Beteiligung von Dritte-Welt-Ländern,
besucht hat, hat sich über die große Bandbreite der dargebotenen Vorträge
gewundert. Dies traf auch auf den Bonner Kongress zu, wenn z.B. aus dem Iran
über antidepressive Effekte von Granatapfelextrakten bei Mäusen gesprochen
wird. Oder wenn eine Vertreterin einer russischen Universität in der Nähe
des Kaukasus Winterweizen als Arzneipflanze bezeichnet. Vergessen werden
darf aber nie, dass Pflanzen und pflanzliche Bestandteile für eine Mehrheit
der Weltbevölkerung eine wesentliche Basis des Gesundheitssystems darstellt,
weil man sich dort teure moderne Arzneimittel einfach nicht leisten kann und
zum anderen gerade viele moderne Arzneimittel oder zumindest die
Wirkprinzipien aus traditionell oder volksmedizinisch verwendeten Ressourcen
aus der belebten Welt entstanden. Warum nicht aus Granatapfel oder
Winterweizen? Dies macht den Reiz derartiger Veranstaltungen aus und diesen
Zusammenhang betonte auch Prof. Blaschek: „Die GA hat sich entschlossen,
diese Veranstaltungsreihe zu unterstützen um gerade an diese
Basisinformationen über Pflanzen und ihre Inhaltstoffe zu kommen.“ Die
Veranstaltung in Bonn gliederte sich in drei „plenary-sessions“ und sechs
Seminare, die teilweise parallel abgehalten wurden. |

Ein Posterpreis ging an Dr. Kelber, Darmstadt
Highlights aus deutscher Sicht waren in den „plenary-sessions“ insbesondere
die Vorträge von Prof. Steffens, Universität Bonn und Prof. Blaschek,
Universität Kiel. Prof. Steffens berichtete über Probleme und
Lösungsmöglichkeiten bei der Tablettierung von pflanzlichen Arzneimitteln.
Gerade hierbei muss die Ideallinie gefunden werden zwischen Kompaktierung,
Granulierung und Verpressung einerseits und dem Auflöseverhalten nach
Einnahme der Tabletten andererseits. Prof. Steffens stellte ein empirisches
Modell vor, wie man über die Kompaktibilität einer Tablettenmischung zu
Aussagen über die Tablettenherstellung im Produktionsmaßstab kommen kann.
Ein weiterer Höhepunkt war der Vortrag von Prof. Blaschek, Universität
Kiel, über „Resveratrol“, einem Inhaltstoff des Rotweins. In einer
beispielhaften Übersicht stellte er die traditionellen und modernen
Erkenntnisse zusammen, kam aber leider zum Schluss, dass es nur beschränkt
überzeugende Nachweise für gesundheitsfördernde Effekte beim Menschen gibt.
Ein zentrales Thema waren auch die Adaptogene, eine klassische Domäne der
medizinisch-pharmazeutischen Wissenschaften Osteuropas. Insbesondere Prof.
Alexander Shikov aus St. Petersburg schlug den Bogen der traditionellen
Anwendung von Adaptogenen zu modernen Erkenntnissen. Heute werden in
Russland acht Arzneipflanzen als Adaptogene anerkannt: Aralia, Echinopanax,
Eleutherococcus, Ginseng, Rhapontikum, Rhodiola, Sterculia und Schisandra.
Aus seiner Sicht ist erwiesen, dass Adaptogene dem Organismus gegen negative
Effekte von Stress helfen und die zelluläre Abwehr gegen reaktiven
Sauerstoff stärken. Klinische Daten gibt es bei der Anwendung gegen
Müdigkeit, Stress und zur Immunstärkung. Die Seminare befassten sich mit
Lebensmittel- und Arzneipflanzen, mit der Kultivierung von Arzneipflanzen,
mit der „Phytotechnologie“, d.h. der Herstellung und Qualitätskontrolle von
pflanzlichen Arzneimitteln. Pharmakologie und Ethnopharmakologie, (was
eigentlich kein Gegensatz sein sollte), waren neben neuen Darreichungsformen
und Wirksamkeitsbeweisen von pflanzlichen Arzneien weitere
Schwerpunkte der Tagung. In seiner bemerkenswerten Schlussrede dankte Prof.
Makarov den Veranstaltern. Er betonte, wie schwierig es war gerade in diesem
Jahr aufgrund finanzieller Schwierigkeiten den Kongress zusammenzustellen
und dankte deshalb ganz besonders den Sponsoren aus Deutschland (Bionorica,
Finzelberg, Klosterfrau, Krewel-Meuselbach, Phytolab, Sanofi-Aventis,
Schwabe und Steigerwald). Er lobte noch einmal die hohe Qualität der
Vorträge und gratulierte den Preisträgern der Poster-Ausstellung, (unter
ihnen Dr. Olaf Kelber, Darmstadt), für die 51 Poster eingereicht worden
waren.
Für den 14. Internationalen Kongress „Phytopharm 2010“, der vom 1. bis 3.
Juli 2010 wieder in St. Petersburg stattfinden wird, lud er alle herzlich
ein.
Cornelia Schwöppe, Kooperation Phytopharmaka, Bonn
|
Der Kongress wurde in
Zusammenarbeit mit
dem Interregional Center "Adaptogen" und der
Universität St-Petersburg veranstaltet.
Hier geht es zum
wissenschaftlichen Inhalt und einigen Photoimpressionen.
HIER
HIER der
erste Presseartikel über die Veranstaltung.
------------------------------------------------------------------------------------------------------------------------
PANalytical GmbH, Regina Heppner, Nürnberger Str.113,
34123 Kassel, Tel : +49 (0)5615742410, Fax : +49 (0)5615742500, E-Mail:
regina.heppner[at]panalytical.com
------------------------------------------------------------------------------------------------------------------------
 

|

Oben: Urkundenübergabe am 16.10.09
Als stolzer Vater kann ich vermelden,
dass meine Tochter und Mitarbeiterin ihr Zweitstudium an der
Charité Universitätsmedizin Berlin mit dem "Master of Science"
(M.Sc.) abgeschlossen hat.
 |
Bilder vom Doktorandentreffen am 16.08.2008:
 Das
unvermeidliche Gruppenbild mit Gastwissenschaftlern. Leider sind
6 Doktorand(inn)en und 2 Gastwissenschaftler verhindert. Das
unvermeidliche Gruppenbild mit Gastwissenschaftlern. Leider sind
6 Doktorand(inn)en und 2 Gastwissenschaftler verhindert. |
Man beachte das "andächtige" Lauschen
bei der unvermeidliche Ansprache: ------>
|
 |
|
Bilder vom Doktorandentreffen 04.08.2007:
Bilder vom Doktorandentreffen 2006:
Wir haben unser erstes
"Doktoranden-Grillfest" mit unseren Gastwissenschaftlern gefeiert.

Gegrillt wurde natürlich normales Grillgut, nicht etwa die Doktoranden!
--------------------------------------------------------------------------------------------------------------------------
Frau Plate
hat mit ihrem Poster bei der DIA- Europa - Tagung in Wien den zweiten
Platz erreicht. Er ist mit 1000,-€ dotiert. Herzlichen Glückwunsch! Erst
am 09.11.06 hat sie die Dissertation begonnen. Ein entsprechender
Artikel ist im DIA- Mitteilungsblatt (HIER)
erschienen.

Um das Poster größer zu sehen
HIER
klicken!
--------------------------------------------------------------------------------------------------------------------------
HIER wird von uns stolz machenden Veranstaltungen berichtet.

Wen der Vortrag interessiert hätte, aber
keine Gelegenheit hatte zum Termin zu kommen,
HIER die
pdf-Fassung der "slides" und
HIER die
mp3-Aufnahme des Tons.
 |

Ich hatte die Ehre als Tagungsleiter dienen zu dürfen.
Siehe auch: http://idw-online.de/pages/de/news280935
|
 |

 |
--------------------------------------------------------------------------------------------------------------------------
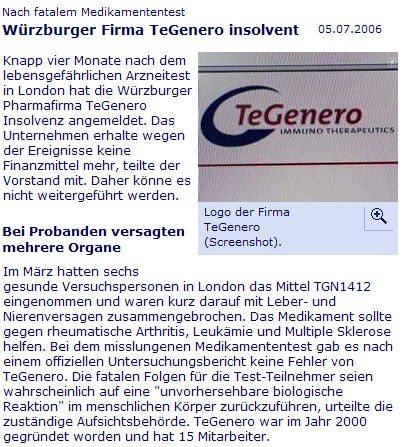
Pharmakovigilanz:
Peter Schönhöfer und ich
haben unsere Gedanken zu TeGenero und zur D[R]AMA in einem Artikel
"Race to the Bottom" in der Pharmazeutischen Zeitung, 20,
1864/1866 (2006) zusammengefasst
HIER.
Eine von mir erweiterte und aktualisierte Fassung lesen Sie in der
Versicherungsmedizin
3, 144-146 (2006) HIER..

------------------------------------------------------------------------------------------------------------------------
 |
 |
"Historische Erinnerungen" an vollmundige Sprüche (vom 22.03.05)
sollte man immer im Gedächtnis behalten. Der Stau ist seit 2006
abgebaut, oder?
Das BfArM zeigt die "Erfolge" der Umstrukturierung auch in den
Zahlen. In Europa besser auf Kosten der nationalen Zulassung.
Bitte erinnern Sie sich: Zu meiner Zeit war auch noch die
Nachzulassung zu bearbeiten! |
|
Anmerkung aus der Weltpolitik.
Andere Länder, unmenschliche Sitten: |
 |
------------------------------------------------------------------------------------------------------------------------
Wenn Sie sich für "drug regulatory
affairs" und die DGRA in Deutschland interessieren:
HIER
habe ich eine Presseübersicht der Jahre, in denen ich Vorsitzender der DGRA
war, zusammengestellt.
Den letzten Stand der BfArM - Performance
unter meiner Leitung finden Sie
HIER.
Wie es mit dem Lehrstuhl werden soll ist, m. E. sehr schön von Frau Dr.
Blasius geschrieben, in der DAZ zu lesen:
Für regulatorische Meldungen aus 2009/2010
HIER
klicken!
Jüngere Arbeiten und Vorträge von
Dr. Jörg Fuchs:
Veröffentlichungen:
IFuchs J, Heyer
T, Langenhan D, Hippius M. New font size requirements in package inserts
of medicines. PharmInd 2010, 72(12):2032-2036.
Fuchs J, Werner
S, Scheunpflug C, Götze EA, Elstermann K, Scheffel K, Domnowski A, Peter
G, Hertzsch C, Hippius M. Excessive medical information increase in
package inserts.
International Journal of Clinical Pharmacology and Therapeutics 2010,
48(12):781-790.
Hertzsch C, Fuchs J, Schweim
JK, Schweim HG. Die Packungsbeilage: Anforderungen des Haftungsrechts.
PharmInd
2010, 72(7):1189-1196.
Fuchs J, Finke
A, Hippius M. Ambivalent Dosage Instructions for Children.
PharmInd 2010,
72(4):602-606.
Fuchs J. The
way forward in package insert user tests from a CRO's perspective.
Drug Information
Journal 2010, 44(2):119-129.
Fuchs J, Götze EA,
Scheunpflug C. Update des QRD-Templates und daraus resultierende
Änderungen in Packungsbeilagen und Fachinformationen. PharmInd 2011,
73(4):670-678.
Wolf A, Fuchs J, Schweim HG.
QRD Template Texts
Intended for Package Inserts - Development from the first QRD template
up to the new draft of July 2012. PharmInd 2012, 74(9):1540-1549.
Fuchs J, Scheunpflug C, Götze EA.
The influence of
the European Union's QRD template on the use of package inserts compared
with a shorter model template. PharmInd 2012, 74(1):126-136.
Fuchs, J. Statement zum Entwurf des
QRD-Templates (Diskussionsstand: Juli 2012)
http://www.paint-consult.com/de/publikation/pdf/PAINT-Consult_statement_QRD_template_draft_20120808.pdf
Fuchs, J. Statement zum Entwurf des
QRD-Templates (Diskussionsstand: April 2012)
http://www.paint-consult.com/de/publikation/pdf/PAINT-Consult_statement_QRD_template_draft_20120503.pdf
Fuchs J. QRD-Template:
Harmonisierung von Produktinformationstexten.http://www.forum-institut.de/de/reg-affairs-newsletter/februar-2013/.
Fuchs J.
Patientenfreundliche Packungsbeilagen unter ökonomischen und
regulatorischen Gesichtspunkten.
http://www.forum-institut.de/de/reg-affairs-newsletter/august-2013/.
Vorträge:
25. Oktober 2010, Bonn
Pharmazeutisches Kolloquium der Rheinische
Friedrich-Wilhelms-Universität Bonn, Thema: „Patientengerechte
Patienteninformation mittels Packungsbeilagen - Stand und Perspektiven".
26. November - 3. Dezember
2010, Bonn, Trainingsprogramm für die chinesische Zulassungsbehörde
(State Food and Drug Administration) durch die Rheinische
Friedrich-Wilhelms-Universität Bonn, Drug Regulatory Affairs,
Thema:
„Guideline on Readability Testing".
06. April 2011, London Meeting des
Europäischen Verbands der Arzneimittel-Hersteller (AESGP)
Thema: „The ideal OTC package insert".
25. Februar 2011, Bonn QRD-Template Workshop des
Veranstalters FORUM Thema: „Die kommenden QRD-Templates".
24. Februar 2012, Bonn
QRD-Template Workshop des Veranstalters FORUM Thema: „Die neuen
QRD-Templates".
04. Februar 2012, Berlin 6.
Jahreskonferenz Pharma Packaging 2012 Thema: „Die neuen QRD-Templates
für die Produktinformationen".
21. Oktober 2013, Bonn
Praxisworkshop Packungsbeilage Thema: „Packungsbeilagen selbst schreiben
& optimieren - Tipps für die Praxis".
01. März 2013, Bonn
QRD-Template Workshop Thema: „Nutzung der QRD-Templates".
28. Januar
2013, Dublin AESGP-Meeting Thema: „Shorter QRD template for better
package inserts.
17. und 18.
Januar 2013, London 12. EGA Regulatory und Scientific Affairs Konferenz
Thema: „Learning from current experience - did readability tests improve
the quality of information and satisfy patients' needs?".
Jüngere Arbeiten von Prof. Dr. Rüdiger Siekmeier:
Veröffentlichungen:
S. Häusermann, D. Kappeler, A. Schmidt und R.
Siekmeier, "Fractional Exhaled Nitric Oxide in Clinical Trials: An
Overview" in M. Pokorski (ed.), Neurobiology of Respiration, Advances in
Experimental Medicine and Biology 788,
DOI 10.1007/978-94-007-6627-3_34, Springer Science, 2013.
Poster:
J. Hannig und R. Siekmeier, "Is the quality of customer
information in cases of product problems of tests and reagents for
infection testing sufficient? Analysis of data published by BfArM 2005 -
2012", poster presentation for the 65th Annual Meeting of the
German Society for Hygiene and Microbiology (DGHM), 22nd - 25th
September 2013 in Rostock, Germany.
J. Hannig und R. Siekmeier,
"Qualität der Kundeninformationen bei Produktproblemen von Professional
use In-vitro Diagnostika zur Gerinnungsuntersuchung im Zeitraum von 2005
- 2012" und
Hannig und R. Siekmeier,
"Qualität der Kundeninformationen bei Produktproblemen von In-vitro
Diagnostika zur hämatologischen Diagnostik im Zeitraum von 2005 - 2012"
und
Graciela Delgado,
Rüdiger Siekmeier, Tanja Grammer, Hubert Scharnagl und Winfried März,
"Hochsensitives CRP (hsCRP) und Myeloperoxidase (MPO) bei Rauchern und
Nichtrauchern der Ludwigshafen Risk and Cardiovascular Health Study
(LURIC)" und
Graciela Delgado,
Marcus
Kleber, Rüdiger
Siekmeier, Winfried März und Hubert Scharnagl, "Anreicherung
triglyceridreicher Partikel ohne Hinweis auf kleine dichte LDL (sdLDL)
bei LURIC-Patienten mit eingeschränkter Nierenfunktion",
alle: 44. Jahrestagung
der Österreichischen Gesellschaft für Innere Medizin 26. - 28. September
2013, Salzburg Congress.
Jüngere Arbeiten und Vorträge von
RA Janna K. Schweim, M. Sc.:
Veröffentlichungen:
J.K.
Schweim und H.G. Schweim, "Versandhandel
und Arzneimittelfälschungen",
"Medizinische Klinik" 2 (104) 163 - 169 (2009).
V. Plate,
C. Behles,
J.K.
Schweim
und H.G. Schweim,
Nicht zugelassene Arzneimittel:
Maßnahmen zur Minimierung der Risiken,
Dtsch. med.
Wochenschrift, 134, 944
- 948 (2009).
J.K.
Schweim und H.G. Schweim, "Zweifel
an der Rechtskonformität des DIMDI – Siegels",
Deutsche Apotheker Zeitung, 24, 74 - 75 (2009).
J.K.
Schweim und H.G. Schweim, "Neue
Sumpfblüte des Online - Versandhandels", Deutsche Apotheker Zeitung, 30, 42 - 45 (2009).
J.K.
Schweim und H.G. Schweim, Verbrauchersicherheit:
"Arzneimittel, Medizinprodukte und Nahrungsergänzungsmittel – ein
Vergleich ",
DAZ.online,
Deutschen Apotheker Zeitung,
http://www.deutsche-apotheker-zeitung.de/misc/dazonline-artikel.html (28.01.2010)
J.K.
Schweim und H.G. Schweim,
"Rabatte,
Zugaben und Bonussysteme in Apotheken", Deutsche Apotheker Zeitung,
44, 82 - 84 (2010).
J.K.
Schweim und H.G. Schweim,
„PillenVZ“,
Deutsche Apotheker Zeitung, 46, 80 - 82 (2010).
J.K.
Schweim und H.G. Schweim, "Bennewitz
– Eyecare, Drugs and More", Deutsche Apotheker Zeitung,
48, 87 - 89 (2010).
Dr. Kerstin Brixius, Alexander Maur,
Janna K. Schweim, OLG München, Urteil vom 26. 11. 2009:
Anwendbarkeit
des FSA-Kodex mit Anmerkung, Arzneimittel und Recht,
02 , 91 -94 (2010).
C. Hertzsch, J. Fuchs, J.K. Schweim und H. G.
Schweim,
"Die
Packungsbeilage: Anforderungen des Haftungsrechts;
Was muss der pharmazeutische Unternehmer in Bezug auf Inhalt und Gestaltung
der Packungsbeilage beachten?"
Pharm. Ind. 7, 1189 -1197 (2010).
J.K. Schweim und H.G. Schweim,
"Radiopharmaka – Zulassung und
Verbraucherschutz",
Arzneimittel und Recht
online 01/2011.
http://www.arzneimittel-und-recht.de/
Siehe auch: http://www.hzdr.de/db/Cms?pOId=12838&pFunc=Print&pLang=en
J.K. Schweim und H.G. Schweim,
M. Baehr,
"Arzneimittelfälschungen, auch
ein Problem im Krankenhaus?",
Krankenhauspharmazie, 4, 199 - 203
(2011)...
J.K.
Schweim und H.G. Schweim,
„Arzneimittelherstellung durch Ärztinnen und Ärzte sowie andere zur Ausübung
der Heilkunde befugte Personen“, naturamed, 3 35 - 40 (2011).
J.K.
Schweim und H.G. Schweim, Überwachung und Haftung:
"Arzneimittelherstellung durch Heilpraktiker",
Naturheilpraxis mit Naturmedizin 5, 581 - 584 (2011).
J.K. Schweim und
H.G. Schweim, "Sind
Nullretaxationen von Betäubungsmittelrezepten rechtens?",
Deutsche
Apotheker Zeitung, 4, 77 - 79 (2012)..
J.K.
Schweim "Macrogolhaltige Produkte - Arzneimittel oder Medizinprodukte", Arzneimittel und Recht 1, 16 - 19 (2012).
J.K.
Schweim
und H.G.
Schweim,
„Drug Shortage“ – Bald auch ein deutsches
Problem?", Deutsche
Apotheker Zeitung,
13, 56 - 59 (2012).
J.K.
Schweim,
„Hände weg von E-Zigaretten"- Kommt jetzt
auch in Deutschland das Aus für die E-Zigarette?, Deutsche
Apotheker Zeitung,
36, 37- 38 (2012).
J.K.
Schweim, "Melatonin - Amerikanisches Nahrungsergänzungsmittel in
Deutschland?", Pharmazeutische Zeitung, 42, 108 - 111 (2012).
J.K. Schweim und
H.G. Schweim, Lieferengpässe
- Eine Folge von Sparpolitik und Preiswettbewerb bei Arzneimitteln?,
Deutsche Apotheker Zeitung, 9, 56 - 60 (2013).
J.K.
Schweim
und H.G. Schweim,
"The Health Claims Regulation and its Consequences". Vortrag zum
17. Intern. Congress Phytopharm 2013 vom 08. - 10. Juli 2013 in Wien.
Abstract
in:
Obzory po klinicheskoj farmakologii i lekarstvennoj terapii (S.Peterburg)
S. 82, ISSN 1683-4100
J.K.
Schweim,
"Noceboeffekt vermeiden. Aber wie? –
Arzt und Patient im Dilemma zwischen Aufklärung und deren negativen Folgen",
Deutsche Apotheker Zeitung, 47, 68 - 70(2013).
J.K.
Schweim,
"Bereicherung zulasten der GKV. Private
Arzneimittelverkäufe im Internet sollten explizit verboten werden", Deutsche
Apotheker Zeitung, 51, 26 - 27 (2013).
J.K.
Schweim
und H.G. Schweim, "Risiko Pharmakovigilanz? Der Fall Metoclopramid und
die Frage des Patientenschutzes", Deutsche Apotheker Zeitung, 19, 54
-59 (2014).
J.K.
Schweim, "Die
klinische Prüfung von Arzneimittel-Medizinprodukte-Kombinationen",
Arzneimittel und Recht, 3, 108 - 112 (2014).
J.K.
Schweim, "Challenges of Post-Authorisation
Safety Studies".
Vortrag zum
18th International Congress Phytopharm 2014 vom 03. bis 05. Juli 2014 in
St. Petersburg/Russland.
Abstract
in: Obzory po klinicheskoj farmakologii i lekarstvennoj terapii (S.Peterburg) Supplement
2014, S. 57, ISSN 1683-4100.
J.K.
Schweim
und H.G. Schweim,
"Status quo and future developments of
combinations of medicinal products", Synergy (2014) 1 (1), 70-75,
ISSN 2213-7130.
A. Maur, J.K. Schweim,
"Auftragsforschung - Hinweise zu Vertragsgestaltung und
Verhandlungsführung". Pharm.Ind. 6, 787-940 (2015).
J.K.
Schweim,"Comparison and differentiation
between clinical trials with medicinal products and scientific studies with
nutritional products".
Vortrag zum
19th International Congress Phytopharm 2015 vom 21. bis 24. Juli 2015 in
Bonn/Deutschland.
Abstract
in:
Obzory po klinicheskoj farmakologii i lekarstvennoj terapii (S.Peterburg),
Supplement 2015, S. 85, ISSN 1683-4100.
Vorträge: Janna K. Schweim, "Unterschiede zwischen einem traditionellen
akademischen Studiengang und einem nicht-konsekutiven Masterstudium
-Erfahrungsbericht", Rotary Club Bonn-Rheinbach 17.11.2009
Janna K.
Schweim, Einladungsvortrag,
Studiengang "Master in Drug Research",
"German & EU industry management and
industry moral rules of drugs and medical devices" , Universität
Bonn, am 22.05.2013 in Bonn
Janna K.
Schweim, Einladungsvorträge,
Studiengang "Consumer Health Care",
"Monitoring of Pharmaceuticals
sold via the Internet" und "German & EU industry
management and industry moral rules of drugs and medical devices", Charité Universitätsmedizin, Humboldt-Universität Berlin am
13.06.13
in Berlin.
Janna K.
Schweim
und H.G. Schweim,
"The Health Claims Regulation and its Consequences". Vortrag zum
17. Intern. Congress Phytopharm 2013 vom 08. - 10. Juli 2013 in Wien.
Janna K.
Schweim, Einladungsvortrag,
Studiengang "Master in Drug Research",
"Arzneimittelzulassung in den USA" , Universität
Bonn, am 28.05.2014 in Bonn.
Janna K.
Schweim, Einladungsvortrag,
Studiengang "Master in Drug Research",
"Arzneimittelzulassung in den USA" , Universität
Bonn, am 31.07.2013 in Bonn.
Janna K.
Schweim, Einladungsvorträge,
Studiengang "Consumer Health Care",
"Arzneimittelfälschungen", "Monitoring of Pharmaceuticals
sold via the Internet" und "German & EU industry
management and industry moral rules of drugs and medical devices", Charité Universitätsmedizin, Humboldt-Universität Berlin am
20.06.2014
in Berlin.
Janna K.
Schweim, Einladungsvortrag,
Studiengang "Master in Drug Research",
"Publication Information and Trade Control
of Pharmaceuticals sold via the Internet" , Universität
Bonn, am 02.07.2014 in Bonn.
Janna
K.
Schweim, "Challenges of Post-Authorisation Safety Studies". Vortrag zum
18th International Congress Phytopharm 2014 vom 03. bis 05. Juli 2014 in
St. Petersburg/Russland.
Janna K.
Schweim, Einladungsvortrag,
Studiengang "Master in Drug Research",
"Monitoring of Pharmaceuticals
sold via the Internet" , Universität
Bonn, am 16.07.2014 in Bonn.
Janna
K. Schweim, "Market authorisation of
drug combinations – examples of borderline cases in the EU". Vortrag
zur Konferenz MipTec 2014, 23. bis 25. September 2014 in
Basel/Schweiz.
Janna
K. Schweim, "Die Verwendung von Botanicals in Arznei-
und Lebensmitteln - nationale Einstufungen und Unterschiede", BAH, AG
"Grenzgebiet Arzneimittel", am 29.06.2015 in Bonn.
Janna
K. Schweim,
"Comparison
and differentiation between clinical trials with medicinal products and
scientific studies with nutritional products",
Vortrag zum 19th International Congress Phytopharm 2015 vom 21.
bis 24. Juli 2015
in Bonn.
Jüngere Arbeiten und Projekte von Dir. u. Prof. Dr. Christian
Behles: C. BEHLES, M. HUBER, M. HABERKAMP: Sicherheit und Qualität der Therapie
der Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung mit Methylphenidat.
Bulletin zur Arzneimittelsicherheit. Ausgabe 3 - September 2013,
C. BEHLES, J. ROTTHAUWE: Nutzen-Risiko-Verhältnis von Tetrazepam.
Bulletin zur Arzneimittelsicherheit. Ausgabe 2 - Juni 2013,
S. CHATTERJEE, C. BEHLES: Krebsrisiko und kardiovaskuläre Mortalität
durch Sartane? Aktueller Stand der Diskussion. Bulletin zur
Arzneimittelsicherheit. Ausgabe 4 - Dezember 2011
12/12- Biosafety/Biosecurity training in Central Asia On behalf
of the EU Commission monitoring training activities in BIOSS in
Kazakhstan and Tajikistan
05/12 Moscow, Hospital #12 Co-inspection of a clinical site on
behalf of the European Commission
01/12
Hungarian CRO, Balatonfüred Audit of the CRO (ICH-GCP
compliance)
11/11
German CRO, specialized in Phase I-II studies Audit of the CRO
(ICH-GCP compliance)
09/11-
German Biotech Company, Martinsried Monitoring of a Phase II
study for a German Biotech Company
08/11
FOCUS GmbH, Neuss, Germany Audit of the Final Study Report of a
phase I study for an Italian Pharmaceutical firm
04/11
German CRO Due Diligence of a CRO in Chisinau, Republic of
Moldova
03/11
FOCUS GmbH, Neuss, Germany Audit of the Final Study Report of a
phase I study for an Italian Pharmaceutical firm
10-12/10
German CRO;TOP 10 EU drug producer Implementing an ISO 2001:2008
Quality Management System at a CRO; Contract Lead Auditor
09/10
ICH-GCP Training courses in Ukraine Conducting ICH-GCP training
courses 07/10, 08/10 German CRO operating in the Republic of
Moldova (Chisinau) Auditing of a phase I study for an Italian
Pharmaceutical firm
01-05/10
TOP 5 Vaccines manufacturer Contract Lead Auditor
Gielsdorf W (2007): Marketing Authorization & Marketing of
Pharmaceuticals in Russia/Belarus/Ukraine FORUM Intensiv
Seminar, 06 NOV 2007, Hilton, Düsseldorf
Gielsdorf W (2003): Pharmamärkte in Zentral- und Osteuropa:
Chancen und Risiken aufgezeigt am Beispiel der Ukraine
Pharm Ind 65(8), 762-767
Jüngere Arbeiten von Dr. Günter H. Hennings:
European Federation of Pharmaceutical Industries’
Associations (EFPIA), Regulation 2000 – The future of medicines’
regulation in Europe, A Discussion Document, Brussels April 1998
(Co-Author).
Hennings, G. Marketing Authorizations of Medicinal Products in the
European Union: Past, Present, and Future. Drug Information Journal 34
(3), 793-800, (2000).
Hennings, G., Scheeren, J.: European Union Community Referrals: Current
practices, experiences and expectations, The Regulatory Affairs Journal,
13, 2, 93-102 (2002).
Hennings, G.: Scientific Advice -A strategic Element of Pharmaceutical
Development, ESRA Rapporteur, 9 (3), 24-29 (2002).
Hennings G.: Better medicines for children in Europe-but how and when?
ESRA Rapporteur 9(5) 3-6, 2002).
Hennings G.: Bio-generics; Generic medicinal products from
biotechnology: do they exist today, will they exist in future? ESRA
Rapporteur 9(6) 27-33, 2002Hennings H G: The European Union, (in
Japanese): General Regulatory Environment for Medicinal Products and
Medical Devices, Medicinal Products for Human Use, Part 1:
Investigational Medicinal Products & Regulatory Aspects of Clinical
Development, Medicinal Products for Human Use, Part 2: Marketing
Authorisation and Post-Authorisation Activities, Medical Devices,
Medicinal Products for Veterinary Use (VMP), (Pharmaco)-Vigilance of
Medicinal Products and Medical Devices, Medicinal Products and Medical
Devices: Current and Future Trends of Regulatory Policies, ??????????
KOKUSAI SHOGYO publishing corp., 2006, 2007.
Hennings G, Trouvin J H, European Union: Regulatory Trends for Biotechnology
and Advanced Therapy Medicinal Products, in: Revet T, Vidal L (eds.),
Annales de la régulation 2009, Bibliothèque de l'Institut de Recherche
Juridique de la Sorbonne - André Tunc, IRJS Editions, ISBN:
978-2-9534539-1-1, Vol. 19 - 2, pp 431-450, June 2009 .
Hennings G, Postmarketing Evaluation, in Cartwright A C & Matthews B R,
(eds.), International Pharmaceutical Product Registration, 2nd Edition, Series: Drugs and the Pharmaceutical Sciences, Volume 200, New York, August,
2009 (ISBN-13: 978-1420081763)
Hennings G, Pregnancy and Children, in Cartwright A C & Matthews B R,
(eds.), International Pharmaceutical Product Registration, 2nd Edition, Series: Drugs and the Pharmaceutical Sciences, Volume 200, New York, August,
2009 (ISBN-13: 978-1420081763)
Jüngere Projekte von
Dr.
Ndjamawe
Bah-Traore:
Training
on Advanced
Good
Manufacturing
Practices (GMP)
Training
for Regulators and Manufacturers in
ECOWAS, Accra, 25-27
September, 2013
Jüngere Projekte von Dr. Thierry O. C. Edoh:
CCONCHO Projekt :
In the last past thirty years several
African countries had initiated lot of local and (inter-)regional
Programs to eradicate the Neglected Tropical Diseases (NTDs). For
example many efforts were conducted from 1974 to 2002 in West Africa
within the Onchocerciasis Control Program (OCP) and from 1997 to 2011
within the SAFE strategy program1 implemented by the Global Alliance for
the Elimination of Trachoma by 2020 (GET2020), to reduce the burden
related to the two diseases. About 1.5 million people are cured of river
blindness2 and children that were born in the controlled areas of the
OCP were exempt from the river blindness risk. For 2011, it was
estimated that 325 million people live in trachoma-endemic areas in the
world. Altogether 36 countries reported implementation of SAFE program
and seven countries with two from Africa reported achievement of the
Ultimate Intervention Goals3 (UIGs) and the number of countries that
have carried out epidemiological assessments is steadily increasing.
Nevertheless onchocerciasis and trachoma, blindness diseases, remain
important health problem with enormous economical, social, and
environmental impacts in the most African countries. Despite the
development of many tools to detect pathogens, human body exploration,
rapid diagnostic tests, computer related tools, several African
countries are unable to benefit from this arsenal to improve the health
of their population. Also the actual complexity of socio-ecological
systems in face of global changes (mainly climate change) and their
impacts on the health and wellbeing of communities calls upon new
methodological approach in the control of diseases. We propose a
consortium of two German research institutions4 and the Community of
Practice EcoHealth in West and Centre Africa (CoPEH-WCA), a Sub-Saharan
African research network5 to join theirs efforts to reduce the burden of
onchocerciasis and trachoma. The proposed research strategy is to define
a global framework of an integrated research-action approach known as
EcoHealth (Ecosystems and Health) for developing and promoting
appropriate adaptive strategies to permanently prevent the resurgence of
the onchocerciasis and trachoma in west and central Africa.
WearHealth
Projekt:
The WHO framework of Global Burden of
Disease (GBD) aims to provide consistent and comparative description of
the burden of diseases, injuries and risk factors - in all regions of
the world. Low GBD is desired for an ideal health situation where the
entire population lives to an advanced age, free of disease and
disability. To this date, patient empowerment is a well established
concept in the developed countries –that focuses on promoting autonomous
self-regulation in order to maximize the individual’s potential for the
health and wellness. The Mobile Virtual Community for Telemedicine
(MVC4TM) is the latest ICT-driven preventive measure that continues to
demonstrate practical benefits for patient empowerment in the developed
countries. Currently, the developing countries contribute to almost 90%
of GBD worldwide. In comparison to the developed countries, the
population of developing countries lags majorly behind in achieving
ideal health situation. Since ICT is a global phenomenon, the technology
base for introducing MVC4TM is already available to the most of the
population in the developing countries. However, following are major
challenges in using MVC4TM for the patient empowerment in the developing
countries. 1) No specific guidelines are available for building a
successful MVC4TM system. 2) There exist multiple challenges in the
current healthcare system and ICT resources availability in the
developing countries – those need further investigation. 3) It is
necessary to promote MVC4TM as a radical and most efficient approach to
improve the health situation of the developing country population,
rather than mere communication and entertainment facility. This proposal
is a joint effort by the researchers in the EU and ICPC countries
towards assessing the potential of MVC4TM for patient empowerment in the
selected regions of two developing countries – India (Asia) and Benin
(sub-Saharan Africa) in three cross-cutting dimensions – healthcare,
technology, and business.
Off-Label-Use Projekt:
The motivation for this project stems
from the observation that there is a legal uncertainty among health care
professionals as to what medical uses exactly fall under the term of off
label use. The lack of a common definition complicates comparison of
methods of resolutions in different countries.[1]
A current ambiguity is shown to cause false patient education and
invalid informed consent, hence leading to liability concerns.
The demand for NDU
information, every day obstacles in NDU and the rationale of
advertisement law restricting drug information on NDU are the motivation
for this project. Health care professionals are in need of drug
information to assure safety of treatment, but legislative hurdles may
hinder access to information while at the same time broad dissemination
of off label information is considered a risk of circumventing marketing
authorization. The motivation for this project is to develop techniques
on the model of UK NHS trust’s guidances to thus assure safe off label
use. The rationale for this project is based on first the need for a
harmonized understanding and definition of off label use, second to
respond to health care professionals’ problems by exploring ways in
which off label use can be managed in the short and long term as well as
to lastly overcome some current limitations of off label use as regards
e.g. reimbursement. The objective of this research is to characterize
and compare the approaches to advertisement rules, quality assurance
measures and legal concepts. Another objective of this research is to
conduct a review of existing data capturing and data derived development
techniques. The closing objective of this study is to draft guidance. As
a final point, this research is to confirm or disprove whether in order
to improve off label use, consolidated findings must open out into
marketing authorization.

|
